Axonics Modulation Technologies, Inc. (NASDAQ : AXNX), une société de technologie médicale spécialisée dans le développement et la commercialisation de nouveaux dispositifs implantables de neuromodulation sacrée (« NMS ») pour le traitement des problèmes de dysfonctionnement urinaire et intestinal, a annoncé aujourd’hui les premiers résultats positifs issus de l’étude pivot ARTISAN-SNM, visant à obtenir l’approbation marketing de la Food & Drug Administration (« FDA ») américaine pour le r-SNM® System d’Axonics1.
Ce communiqué de presse contient des éléments multimédias. Voir le communiqué complet ici : https://www.businesswire.com/news/home/20190220005418/fr/
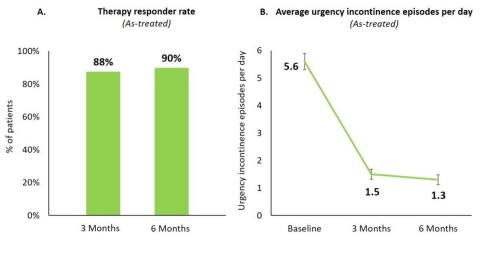
Figure 1A & 1B
L’étude clinique a démontré que les patients implantés avec le r-SNM System d’Axonics avaient obtenu des améliorations statistiquement importantes et cliniquement significatives des symptômes d’incontinence urinaire par impériosité (« IUI ») et de leur qualité de la vie. L’étude a rempli par ailleurs deux critères d’évaluation secondaires. Aucun événement indésirable grave lié au dispositif n’a été rapporté.
L’étude ARTISAN-SNM est une étude clinique pivot prospective, multicentrique, sans insu, à un seul bras, menée sur 129 patients, et approuvée en vertu de la dispense de mise à l’essai d’un appareil expérimental (Investigational Device Exemption, « IDE »), de la FDA, visant à évaluer la sécurité et l’efficacité du r-SNM System d’Axonics pour lutter contre le dysfonctionnement urinaire. L’étude a été conduite dans 14 centres aux États-Unis et dans 5 centres en Europe occidentale.
Karen Noblett, M.D., médecin en chef d’Axonics, a commenté : « La réussite de cette étude clinique marque une étape importante de notre procédure en vue d’obtenir l’approbation de la FDA. Jusqu’à présent, la thérapie par NMS était uniquement disponible avec un neurostimulateur implanté non rechargeable d’une durée de vie moyenne de quatre ans, qui nécessitait une intervention chirurgicale de remplacement en raison de l’épuisement de la batterie du neurostimulateur. Nous considérons, qu’en plus de réduire les coûts pour les patients et les organismes payeurs, le système Axonics rechargeable de 5 cc miniaturisé, certifié pour demeurer dans l’organisme pendant au moins 15 ans, permet d’encourager sensiblement l’adoption de la thérapie par NMS. »
Premiers résultats
Une sonde crantée et le neurostimulateur Axonics ont été implantés sur tous les patients diagnostiqués avec une IUI, et répondant aux critères de l’étude. Les données d’efficacité ont été recueillies en utilisant un journal mictionnel sur 3 jours, un questionnaire validé sur la qualité de vie (ICIQ-OABqol), et un questionnaire de satisfaction. Les répondants au traitement ont été identifiés comme des patients présentant une réduction d’au moins 50 % des épisodes d’incontinence par impériosité, enregistrés aux visites de suivi, par rapport à l’entrée dans l’étude. Une analyse basée sur le traitement réel, ou « as-treated », a été effectuée sur l’ensemble des 129 patients implantés.
À six mois, 90 % de tous les patients implantés étaient des répondants au traitement (Figure 1A), parmi lesquels 80 % présentaient une réduction ≥ 75 % des épisodes d’incontinence par impériosité, 34 % étant entièrement secs.
Pour l’ensemble des patients, le nombre d’épisodes quotidiens d’incontinence par impériosité a régressé, passant de 5,6 ± 0,3 (moyenne ± erreur-type) à la référence, à 1,3 ± 0,2 à six mois (p < 0,0001 ; Figure 1B).
Les patients ont présenté une amélioration moyenne statistiquement et cliniquement significative du score composite ICIQ-OABqol (34 points) à six mois, par rapport à la référence ; et 93 % de tous les patients implantés étaient satisfaits de leur traitement par NMS rechargeable.
Statut de l’approbation préalable à la commercialisation (Premarket Approval, PMA) de la FDA américaine
Axonics a déposé une demande de PMA le 3 décembre 2018, et les données cliniques provisoires de l’étude ARTISAN-SNM auprès de la FDA à la fin 2018. Les données cliniques mentionnées aux présentes n’ont pas encore été examinées par la FDA. Axonics envisage de déposer les données cliniques à six mois, auprès de la FDA, dans la semaine du 18 février. Axonics ne s’attend pas à ce que le dépôt des données cliniques supplémentaires modifie le délai d’examen standard de 180 jours, fixé par la FDA, pour finaliser son examen de la PMA et rendre sa décision par écrit.
Conférence téléphonique et webdiffusion
Comme cela a été annoncé précédemment, la Société tiendra une téléconférence avec la communauté des investisseurs pour discuter des résultats financiers du quatrième trimestre 2018 et de l’exercice complet, ainsi que des récents développements commerciaux, notamment des données cliniques de l’étude ARTISAN-SNM, le mardi 5 mars 2019, à 16 h 30 heure de l’Est.
Les personnes intéressées peuvent accéder à l’appel en direct en composant le (866) 687-5771 (États-Unis), ou le (409) 217-8725 (International), puis en indiquant l’identifiant de conférence 3386378. Une webémission en direct de la conférence sera accessible sur la page Events & Présentations, dans la section des investisseurs, du site Web de la Société, à l’adresse ir.axonicsmodulation.com. Une rediffusion de la webémission sera disponible peu après la fin de la conférence, et sera archivée pendant 90 jours sur le site Web de la Société.
À propos de l’hyperactivité vésicale et de la neuromodulation sacrée
L’hyperactivité vésicale (HAV), qui couvre l’incontinence urinaire par impériosité et l’urination fréquente, touche près de 85 millions d’adultes aux États-Unis et en Europe. La HAV est causée par une mauvaise communication entre la vessie et le cerveau, et a un impact significatif sur la qualité de vie. La thérapie par NMS est un traitement bien établi qui a été largement utilisé pour réduire les symptômes et restaurer la fonction de la vessie. Elle est également utilisée pour traiter la rétention urinaire et l’incontinence fécale. Le remboursement de la NMS est bien établi aux États-Unis, et est un service couvert en Europe, au Canada et en Australie.
À propos d’Axonics Modulation Technologies, Inc.
Basée à Irvine, en Californie, Axonics se concentre sur le développement et la commercialisation d’un nouveau système de NMS implantable pour les patients souffrant de dysfonctionnement urinaire et intestinal. Le r-SNM System d’Axonics est le premier système de neuromodulation sacrée, rechargeable, approuvé pour la vente en Europe, au Canada et en Australie. Le r-SNM System offre un système d’essai externe temporaire jetable, un simulateur longue durée miniaturisé et rechargeable, certifié pour fonctionner pendant au moins 15 ans dans l’organisme. Le dispositif intègre également une sonde crantée, ainsi que des accessoires à l’utilisation conviviale pour le patient, tels qu’un système de chargement optimisé afin d’assurer un temps de charge minimal sans surchauffe, une petite télécommande facile d’utilisation, ainsi qu’un programmateur clinique intuitif facilitant le positionnement et la programmation de la sonde. Pour de plus amples informations, consultez le site Internet de la Société www.axonicsmodulation.com
Déclarations prévisionnelles
Les déclarations faites dans le présent communiqué de presse concernant des projets, des événements, des perspectives ou performances futurs constituent des déclarations prévisionnelles au sens de la loi « Private Securities Litigation Reform Act » de 1995. Les termes, tels que « prévu », « s’attend à », « croit », « anticipe », « conçu » et autres expressions similaires sont destinés à identifier des déclarations prévisionnelles. Bien que ces déclarations prévisionnelles reposent sur les attentes et les convictions actuelles de la direction, elles sont soumises à un certain nombre de risques, d’incertitudes, d’hypothèses et autres facteurs susceptibles d’entraîner une différence notable entre les résultats réels et les attentes exprimées dans le présent communiqué de presse, ceci incluant les risques et incertitudes divulgués dans les documents d’Axonics, déposés auprès de la Commission des valeurs mobilières (Securities and Exchange Commission), tous disponibles en ligne à l’adresse suivante : www.sec.gov. Le lecteur est prié de ne pas se fier outre mesure aux présentes déclarations prévisionnelles, qui ne valent qu’à la date de leur formulation. À moins que la loi ne l’impose, Axonics ne s’engage aucunement à mettre à jour ou à réviser toutes déclarations prévisionnelles afin de refléter de nouvelles informations, des changements de circonstances ou des événements imprévus.
______________________
1 Le r-SNM System d’Axonics est actuellement désigné en tant que dispositif médical expérimental
Le texte du communiqué issu d’une traduction ne doit d’aucune manière être considéré comme officiel. La seule version du communiqué qui fasse foi est celle du communiqué dans sa langue d’origine. La traduction devra toujours être confrontée au texte source, qui fera jurisprudence.
Consultez la version source sur businesswire.com : https://www.businesswire.com/news/home/20190220005418/fr/


