La Food and Drug Administration (FDA) américaine a accordé la désignation de dispositif révolutionnaire à la pompe cardiaque percutanée extensible d'Abiomed (NASDAQ : ABMD) Impella ECP. Cette désignation indique que la FDA accordera la priorité aux processus d'examen réglementaire de l'Impella ECP, notamment à la conception itérative, aux protocoles d'études cliniques et à la demande d'autorisation préalable de mise sur le marché (PMA).
Ce communiqué de presse contient des éléments multimédias. Voir le communiqué complet ici : https://www.businesswire.com/news/home/20210818005574/fr/
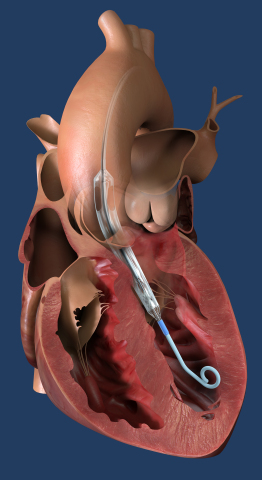
Impella ECP, the world's smallest heart pump, is placed percutaneously into the heart's left ventricle, expands, and supports the heart’s pumping function, providing flow greater than 3.5 L/min. (Photo: Business Wire)
L'Impella ECP est la plus petite pompe cardiaque au monde et la première qui soit compatible avec les techniques d'accès et de fermeture des petits orifices. Elle mesure 9 FG (3 millimètres de diamètre) lors de son insertion et de son retrait du corps. Lorsqu'elle est insérée dans le cœur, elle se dilate pour soutenir la fonction de pompage du cœur, fournissant un débit supérieur à 3,5 l/min.
La FDA a accordé la désignation de dispositif révolutionnaire en partie sur la base des données cliniques positives issues des 21 premiers patients traités avec l'Impella ECP dans le cadre d'une étude de faisabilité de repérage précoce réglementée par la FDA. En accordant cette désignation, la FDA a déterminé que l'Impella ECP satisfaisait les critères rigoureux de la FDA pour un dispositif révolutionnaire.
« Il s'agit d'une nouvelle validation des avantages cliniques de la technologie Impella par la FDA et d'une affirmation de la nature innovante de l'Impella ECP qui, en raison de la taille minimale de son accès vasculaire, pourrait fournir des procédures encore plus sûres et être disponible pour un plus grand nombre de patients qui ont besoin d'une assistance hémodynamique pour une revascularisation coronaire », a déclaré Chuck Simonton, DM, directeur médical d'Abiomed.
Aux États-Unis, on estime que 440 000 patients sont admissibles et pourtant insuffisamment traités pour une ICP à haut risque. La taille de l'Impella ECP peut permettre à davantage de médecins de fournir un soutien hémodynamique critique aux patients atteints de coronaropathie.
Le premier patient au monde traité avec l'Impella ECP est Robert Matthews, un ouvrier automobile retraité de 80 ans originaire de Détroit, père de quatre enfants et grand-père de onze enfants. Pendant plus de 20 ans, Robert a vécu en souffrant d'une maladie cardiaque et enduré de multiples interventions. En 2020, il a été dirigé vers Amir Kaki, DM, un cardiologue interventionnel et directeur de l'assistance circulatoire mécanique à l'hôpital Ascension St. John de Détroit. Le Dr Kaki qui a découvert de multiples obstructions et une fonction cardiaque déficiente, a reconnu Robert comme un candidat approprié pour une ICP protégée avec l'Impella. Robert est devenu le premier patient au monde traité par l'Impella ECP lorsque le Dr Kaki a inséré la pompe cardiaque avant d'éliminer les obstructions pour poser des stents.
Deux jours plus tard, Robert est rentré chez lui, oú sa famille et ses amis ont immédiatement remarqué son regain d'énergie. Aujourd'hui, Robert est reconnaissant envers cette technologie de pointe qui lui a permis de retrouver sa qualité de vie.
Attention : L'Impella ECP est un dispositif expérimental, limité par la loi fédérale à un usage uniquement expérimental.
À PROPOS DES POMPES CARDIAQUES IMPELLA
Les dispositifs Impella 2.5® et Impella CP® sont approuvés par la FDA américaine pour traiter certains patients souffrant d'insuffisance cardiaque avancée et subissant des interventions coronariennes percutanées (ICP) électives et urgentes, comme la pose d'un stent ou une angioplastie par ballonnet, pour rouvrir des artères coronaires obstruées.
L'Impella 2.5, l'Impella CP, l'Impella CP avec SmartAssist®, l'Impella 5.0®, l'Impella LD® et l'Impella 5.5® avec SmartAssist® sont approuvés par la FDA américaine pour traiter les patients victimes d'une crise cardiaque ou d'une cardiomyopathie en état de choc cardiogénique. Ces dispositifs ont la capacité unique de favoriser la récupération du cœur natif et de permettre aux patients de rentrer chez eux avec leur propre cœur.
À PROPOS D'ABIOMED
Basé à Danvers (Massachusetts) aux États-Unis, Abiomed, Inc. est un fournisseur leader de dispositifs médicaux qui fournissent soutien circulatoire et oxygénation. Nos produits sont conçus pour permettre au cœur de se reposer en améliorant le flux sanguin et/ou pour fournir une oxygénation suffisante aux personnes souffrant d'insuffisance respiratoire. Pour plus d'informations, veuillez consulter le site www.abiomed.com.
DÉCLARATIONS PROSPECTIVES
Toute déclaration prospective est soumise à des risques et des incertitudes tels que ceux décrits dans les rapports périodiques d'Abiomed déposés auprès de la Securities and Exchange Commission. Les résultats réels pourraient différer sensiblement des résultats prévus.
Le texte du communiqué issu d’une traduction ne doit d’aucune manière être considéré comme officiel. La seule version du communiqué qui fasse foi est celle du communiqué dans sa langue d’origine. La traduction devra toujours être confrontée au texte source, qui fera jurisprudence.
Consultez la version source sur businesswire.com : https://www.businesswire.com/news/home/20210818005574/fr/

