Abiomed (NASDAQ: ABMD) annonce que les nouvelles données de l'étude PROTECT III montrent une réduction du taux MACCE (décès, AVC, infarctus du myocarde et procédures de répétition) lorsqu'Impella est utilisé pour atteindre une revascularisation plus complète dans un contexte unique pour des patients recevant une intervention coronarienne percutanée (ICP) à risque élevé. PROTECT III est une étude en cours, prospective, à groupe unique, post approbation FDA en vue d'une autorisation PMA (autorisation préalable à la mise sur le marché) pour Impella 2.5 et Impella CP dans les ICP à risque élevé. Les conclusions de l'analyse intermédiaire PROTECT III sont présentées par William O’Neill, DM, directeur médical du Center for Structural Heart Disease à l'hôpital Henry Ford, durant le TCT Connect, 32e symposium scientifique annuel de la Cardiovascular Research Foundation, dans le cadre de la session « Best of Abstracts », aujourd'hui à 15h24 (heure avancée de l'Est).
Ce communiqué de presse contient des éléments multimédias. Voir le communiqué complet ici : https://www.businesswire.com/news/home/20201015006088/fr/
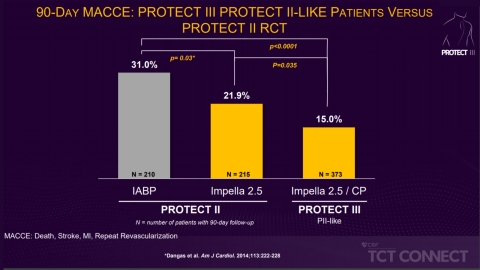
Figure 1 (Graphic: Business Wire)
PROTECT III fait suite à l'essai PROTECT II randomisé et contrôlé qui a démontré qu'en comparaison à une pompe à ballonnet intra-aortique, l'utilisation d'Impella permettait une réduction de 29 % du taux MACCE à 90 jours. Dans PROTECT III, les auteurs de l'étude ont analysé des patients qui auraient été admissibles pour PROTECT II (les patients « assimilés PII »), pour les comparer aux patients PROTECT II. Les patients assimilés PII dans PROTECT III a amélioré les taux MACCE à 90 jours, par rapport aux patients PROTECT II (15 % vs 21,9 %, p=0,035) (voir figure 1).
L'étude a également montré que les patients assimilés PII dans PROTECT III étaient plus âgés, plus malades et plus difficiles à traiter, avec davantage de comorbidités, plus de vaisseaux traités et plus d'athérectomies rotationnelles, mais qu'ils présentaient néanmoins des améliorations en termes d'innocuité en milieu hospitalier, notamment :
- Un nombre nettement inférieur de complications hémorragiques (1,8 % vs 12,5 %, p<0,001)
- Un nombre similaire de complications vasculaires (1,0 % vs 1,4 %, p=0,659)
- Un nombre similaire d'incidences d'AVC (0,40 % vs 0,46 %, p=0,913)
PROTECT I, PROTECT II RCT et PROTECT III constituent la plus grande série d'études cliniques FDA jamais réalisée chez des patients recevant une ICP à risque élevé avec assistance hémodynamique. Cette analyse intermédiaire de PROTECT III comprend 1 143 patients recevant une ICP planifiée non émergente avec Impella dans 45 sites entre mars 2017 et septembre 2019.
« Ces données constituent un important prolongement de la connaissance en matière d'ICP à risque élevé. En reprenant rétrospectivement les données PROTECT II, nous avons compris l'efficacité et l'innocuité d'Impella », déclare Jeffrey W. Moses, DM, chercheur principal de PROTECT III et directeur des thérapies cardiovasculaires interventionnelles et professeur de médecine au Columbia University Medical Center. « Mais à présent, avec les données PROTECT III qui montrent moins d'effets indésirables, nous comprenons comment appliquer les meilleures pratiques et le résultat est une amélioration des résultats des patients ».
« Ces données mises à jour de PROTECT III démontrent clairement comment l'évolution et l'adoption des meilleures pratiques d'Impella peuvent conduire à une amélioration de l'innocuité et des taux MACCE, et elles fournissent des informations importantes alors que nous nous préparons à lancer l'essai PROTECT IV randomisé et contrôlé évaluant Impella dans une ICP à risque élevé », déclare Dr O’Neill.
PROTECT III fait partie d'un corpus croissant de preuves soutenant les avantages d'une revascularisation plus complète dans une ICP à risque élevé, qui conduit à une amélioration des résultats pour les patients. L'étude Restore EF, présentée hier au TCT Connect, démontre que l'utilisation des meilleures pratiques mises à jour avec Impella dans une ICP à risque élevé améliore significativement la fraction d'éjection ventriculaire gauche, les symptômes d'insuffisance cardiaque, et les symptômes angineux à 90 jours de suivi dans divers contextes hospitaliers, y compris dans des centres ruraux, urbains, de collectivité et universitaires. PROTECT III renforce également le corpus général de preuves relatives à l'innocuité d'Impella, décrite en détail dans la figure 2.
L'étude post approbation PROTECT III déterminera les protocoles des meilleures pratiques de la future étude prospective PROTECT IV RCT à deux groupes, qui validera les conclusions clés de l'étude cVAD, de la base de données Impella Quality (IQ) et des données en monde réel recueillies depuis la clôture de PROTECT II RCT. PROTECT IV comparera une ICP à revascularisation complète avec Impella à une ICP à revascularisation complète sans assistance hémodynamique planifiée.
La série d'études PROTECT est parrainée par Abiomed dans le cadre de son engagement à améliorer les résultats cliniques.
Pour partager les meilleures pratiques dans le domaine de l'ICP à risque élevé, Abiomed organise un symposium dans le cadre du TCT Connect, le samedi 17 octobre à 14h00 (heure avancée de l'Est), intituléProtected PCI in COVID-19 Era: The Rise in Importance of Complete Revascularization (L'intervention coronarienne percutanée (ICP) à l'ère de la COVID-19 : augmentation soudaine de l'importance de la revascularisation complète). Le symposium est présidé par Cindy Grines, DM, directrice scientifique du Northside Hospital Cardiovascular Institute à Atlanta et présidente de la Society for Cardiovascular Angiography and Interventions (SCAI). Au programme, seront présentées les meilleures pratiques d'utilisation de l'assistance circulatoire mécanique percutanée pour une revascularisation complète chez les patients à risque élevé.
À PROPOS DES POMPES CARDIAQUES IMPELLA
Les dispositifs Impella 2.5® et Impella CP® bénéficient d'une approbation avant commercialisation de la FDA pour le traitement de certains patients atteints d'insuffisance cardiaque avancée qui subissent des interventions coronariennes percutanées (ICP) planifiées et urgentes, telles que l’angioplastie par pose de stent ou de ballonnet, afin de rouvrir les artères coronaires obstruées. Les dispositifs Impella 2.5, Impella CP, Impella CP avec SmartAssist®, Impella 5.0®, Impella LD® et Impella 5.5™ avec Smart Assist® sont des pompes cardiaques approuvées par la FDA américaine et utilisées pour traiter les patients subissant des crises cardiaques ou atteints de cardiomyopathie en état de choc cardiogénique. Elles ont la capacité unique de permettre la récupération de la fonction cardiaque native, permettant ainsi aux patients de rentrer chez eux sans être greffés. Le dispositif Impella RP® est approuvé par la FDA pour traiter l'insuffisance ou la décompensation ventriculaire droite après implantation d'un dispositif d'assistance du ventricule gauche, un infarctus du myocarde, une greffe du cœur ou une opération à cœur ouvert. L’utilisation en urgence de la pompe Impella RP par du personnel soignant en milieu hospitalier est également permise afin de fournir une assistance ventriculaire droite temporaire pour une période allant jusqu’à 14 jours chez des patients en soins intensifs ayant une surface corporelle ≥ 1,5 m2, pour le traitement de l’insuffisance cardiaque droite aiguë ou de la décompensation causée par des complications liées à la Covid-19, y compris l’embolie pulmonaire. La pompe Impella RP n’a été ni autorisée ni approuvée pour le traitement de l’insuffisance cardiaque droite aiguë ou de la décompensation causée par des complications liées à la Covid-19. Les systèmes d'assistance ventriculaire gauche (VG) Impella sont également autorisés pour une utilisation d'urgence par le personnel soignant en milieu hospitalier pour fournir une décharge et une assistance VG (≤ 4 jours pour Impella 2.5, Impella CP, et Impella CP avec SmartAssist ; contre ≤ 14 jours pour Impella 5.0 et Impella 5.5 avec SmartAssist) dans le traitement de patients en soins intensifs atteints d'une infection à la COVID-19 confirmée suivant un traitement ECMO et ayant développé un œdème pulmonaire durant une assistance ECMO V-A ou une décompensation cardiaque tardive à la suite d'une myocardite durant une assistance ECMO V-V. Les systèmes d'assistance VG Impella n'ont été ni autorisés ni approuvés pour l'indication d'utilisation autorisée. L’utilisation de la pompe Impella RP et des Systèmes d'assistance VG Impella a été autorisée par la FDA pour les cas d’urgence mentionnés ci-dessus, en vertu d’une autorisation d’utilisation d’urgence (EUA - Emergency Use Autorization), et a été autorisée uniquement tant que la déclaration de l’existence de circonstances justifie l’autorisation d’utilisation d’urgence de dispositifs médicaux en vertu de la section 564(b)(1) de la loi, 21 U.S.C. § 360bbb-3(b)(1), à moins que l’autorisation ne soit résiliée ou révoquée plus tôt.
En Europe, les dispositifs Impella 2.5, Impella CP et Impella CP avec SmartAssist sont certifiés CE pour le traitement des patients recevant une ICP à risque élevé et des patients IAM en état de choc cardiogénique pendant une durée maximale de 5 jours. Les pompes Impella 5.0 et Impella LD sont certifiées CE pour le traitement des patients atteints d’un infarctus ou d’une cardiomyopathie en état de choc cardiogénique pendant un maximum de 10 jours. La pompe Impella 5.5 avec SmartAssist est certifiée CE pour le traitement des patients atteints d’un infarctus ou d’une cardiomyopathie en état de choc cardiogénique pendant une durée maximale de 30 jours. La pompe Impella RP est certifiée CE pour le traitement de l’insuffisance ventriculaire droite ou d’une décompensation suite à l’implantation d’un dispositif d’assistance ventriculaire gauche, un infarctus du myocarde, une transplantation cardiaque, une opération à cœur ouvert ou une arythmie ventriculaire réfractaire. Pour en savoir plus sur le portefeuille de pompes cardiaques Impella, y compris leurs indications approuvées et les informations importantes en matière de sécurité et de risque associées à l’utilisation de ces dispositifs, veuillez consulter le site www.impella.com.
À PROPOS D'ABIOMED
Basé à Danvers, dans le Massachusetts, aux États-Unis, Abiomed, Inc. est un fournisseur de premier plan de dispositifs médicaux permettant une assistance circulatoire. Nos produits sont conçus pour permettre au cœur de se reposer en améliorant la circulation sanguine et/ou en effectuant le pompage du cœur. Pour plus d'informations, veuillez consulter le site www.abiomed.com. Abiomed, Impella, Impella 2.5, Impella 5.0, Impella LD, Impella CP, Impella RP et Impella Connect sont des marques déposées d'Abiomed, Inc. et enregistrées aux États-Unis et dans certains pays étrangers. Impella BTR, Impella 5.5, Impella ECP, CVAD Study et SmartAssist sont des marques commerciales d'Abiomed, Inc. en cours de dépôt.
DÉCLARATIONS PROSPECTIVES
Le présent communiqué contient des déclarations prospectives, notamment des déclarations concernant le développement de produits existants et de nouveaux produits d’Abiomed, l’évolution de l’entreprise en matière de croissance commerciale, les opportunités futures et les approbations réglementaires attendues. Les résultats réels de la société peuvent être sensiblement différents de ceux escomptés dans ces déclarations prospectives en raison d’un certain nombre de facteurs, notamment les incertitudes liées à la portée, l’ampleur et la durée de la pandémie de COVID-19, au développement, aux tests et aux approbations réglementaires connexes, comme le potentiel de pertes futures, une fabrication complexe, des exigences de qualité élevées, la dépendance à l’égard de sources d’approvisionnement limitées, la concurrence, les changements technologiques, la réglementation gouvernementale, les litiges, les besoins en capitaux à l'avenir et l’incertitude quant à l’obtention de financements supplémentaires, ainsi que d’autres risques et défis détaillés dans les documents déposés par la société auprès de la Commission américaine des valeurs mobilières et boursières (SEC), notamment le dernier rapport annuel déposé sur formulaire 10-K, ainsi que les documents déposés ou présentés par la suite auprès de la SEC. Le lecteur est prié de ne pas se fier indûment aux déclarations prospectives, qui sont valables uniquement à la date du présent communiqué. La société n’est aucunement tenue de publier les résultats d’une quelconque révision de ces déclarations prospectives qui pourrait être faite afin de refléter des événements ou des circonstances survenant après la date de publication de ce communiqué ou pour refléter la survenue d’événements imprévus.
Le texte du communiqué issu d’une traduction ne doit d’aucune manière être considéré comme officiel. La seule version du communiqué qui fasse foi est celle du communiqué dans sa langue d’origine. La traduction devra toujours être confrontée au texte source, qui fera jurisprudence.
Consultez la version source sur businesswire.com : https://www.businesswire.com/news/home/20201015006088/fr/

