Nicox trouve un partenaire en Corée. La société a licencié son Zerviate à Samil Pharmaceutical en Corée du Sud. L'objectif est d'utiliser le dossier FDA pour une approbation sur ce nouveau marché, ce qui ne devrait pas nécessiter d'étude additionnelle, estime le management de Nicox. Le laboratoire français est éligible à une redevance de 10% des ventes nettes et à un paiement d’étape de 5% sur les ventes nettes pour chaque année civile de chiffre d'affaires dépassant 900 000 USD. Nicox recevra aussi des paiements à la signature du contrat et lors de l'autorisation de mise sur le marché, à hauteur de 250 000 USD. Le développement et la commercialisation seront à la charge de Samil.
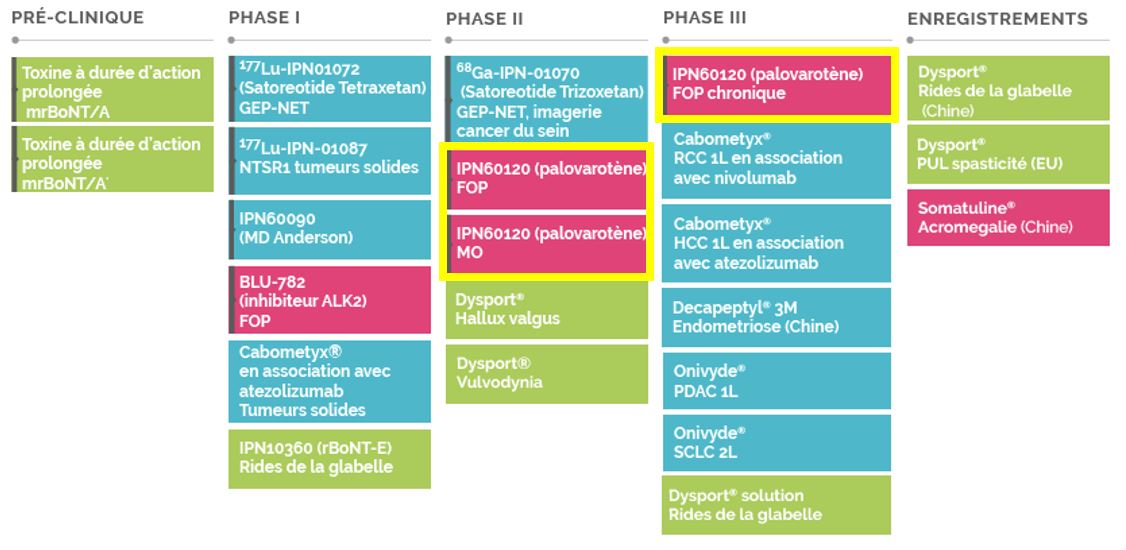
Des doutes sur palovarotène. L'agence américaine du médicament a fait suspendre sur les moins de 14 ans les études IND120181 et IND135403 d'Ipsen avec palovarotène dans le traitement chronique de la fibrodysplasie ossifiante progressive (FOP) et des ostéochondromes multiples (MO). La FDA autorise la poursuite des études dans le traitement des patients âgés de 14 ans et plus. Cette "suspension clinique partielle" s'appuie sur les dernières données de sécurité concernant des cas de fermeture précoce du cartilage de croissance chez des enfants atteints de FOP et traités par palovarotène. Des informations supplémentaires devraient être réclamées par la FDA. Malgré l'absence d'événement adverses dans l'étude MO, celle-ci a aussi été suspendue par précaution. Ipsen précise que la préparation du dépôt du dossier d'enregistrement du palovarotène pour le traitement aigu/épisodique auprès de la FDA se poursuit. Ipsen a récupéré le palovarotène via l'acquisition de Clementia Pharmaceuticals plus tôt dans l'année. L'opération avait été bouclée pour 1,04 Md$, plus un CVG de 6 USD par action conditionné à l'AMM du traitement dans les MO, qui peut faire monter la facture à 1,3 Md$.
ReActiv8 en Australie. Le dispositif de neurostimulation implantable pour la lombalgie chronique invalidante de Mainstay, ReActiv8, a reçu son autorisation de commercialisation en Australie. La société va solliciter l'inscription de son implant au registre de remboursement par les assureurs privés australiens, avec une décision prévue au troisième trimestre 2020.
En bref. L'Institut de génétique humaine de l'Université de Duisburg-Essen a développé un nouveau test pour identifier et caractériser les patients atteints de FAME (Family Adult Myoclonic Epilepsy), grâce à la technologie de peignage moléculaire et aux conseils de Genomic vision. Valneva sera présent sur la 38ème J.P. Morgan Healthcare Conference à San Francisco du 12 au 16 janvier.

 Par
Par 

















