Abiomed (NASDAQ:ABMD), fabricant de la pompe cardiaque Impella, vient d’acquérir Breethe, la société à l’origine du nouveau système d’oxygénation par membrane extracorporelle (ECMO, de l’anglais ExtraCorporeal Membrane Oxygenation) qui viendra compléter et élargir le portefeuille de produits d’Abiomed. Ceci permettra à la société de répondre de manière plus exhaustive aux besoins des patients dont les poumons ne peuvent plus assurer une oxygénation suffisante, y compris en cas de choc cardiogénique ou d’insuffisance respiratoire, comme celle due au SDRA, à la grippe H1N1, au SRAS ou au COVID-19. L’ECMO est également utilisée comme principale méthode d’oxygénation et de soutien hémodynamique en pédiatrie.
Ce communiqué de presse contient des éléments multimédias. Voir le communiqué complet ici : https://www.businesswire.com/news/home/20200429006017/fr/
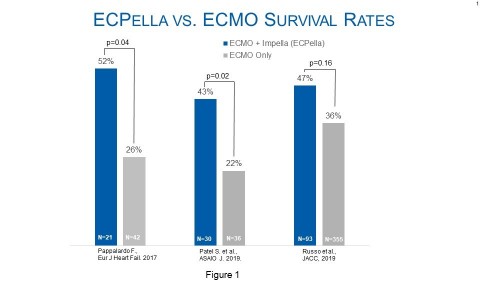
Figure 1 (Graphic: Business Wire)
Les patients qui ont besoin d’une ECMO souffrent en général d’une maladie grave et potentiellement mortelle, qui empêche leurs poumons de fonctionner correctement. Relié au patient par des tubes (les canules), ce dispositif d’assistance respiratoire externe prélève le sang dans une veine, en extrait le dioxyde de carbone et rajoute de l’oxygène, comme le ferait un poumon. Le sang oxygéné est ensuite renvoyé au patient. Chaque année, plus de 20 000 patients bénéficient d’une ECMO aux États-Unis.
Abiomed reconnaît la nécessité d’une ECMO pour les patients ayant besoin d’être oxygénés et a ainsi pris en charge près de 10 000 patients en état de choc cardiogénique grâce à un système ECMO + Impella (ECPellaTM) ces 10 dernières années. Au Japon, plus de la moitié des patients utilisant la pompe Impella ont bénéficié d’une prise en charge ECPella, permettant d’assurer l’oxygénation et le soutien hémodynamique.
Breethe a élaboré un système d’ECMO compact, unique en son genre, facile à utiliser, avec concentrateur d’oxygène intégré pour éviter d’avoir recours à des bouteilles d’oxygène encombrantes, ce qui permet de faciliter les déplacements du patient. Sa conception novatrice permet au personnel médical de l’installer, de l’utiliser et d’assurer le suivi de manière intuitive. Abiomed a investi dans Breethe à la mi-2019. Breethe a fait une demande d’autorisation 510(k) auprès de la Food and Drug Administration (FDA).
Bartley Griffith, fondateur de Breethe, occupe la position de Hales Distinguished Professor of Surgery à la faculté de médecine de l’université du Maryland et est un leader renommé dans de multiples domaines de la chirurgie cardiaque chez les adultes, y compris en matière d’assistance circulatoire mécanique. Dr Griffith collabore avec Abiomed depuis plusieurs années et a été l’investigateur principal de l’étude RECOVER I. Forts de plusieurs décennies d’expérience, Dr Griffith et son équipe ont mis au point le système Breethe pour changer la façon dont l’oxygénation est assurée, ceci afin d’améliorer l’état de santé et la qualité de vie des patients et de réduire le coût total des soins.
« Abiomed est l’entreprise la mieux placée pour continuer sur la lancée de ce que nous avons mis en place, » a déclaré Dr Griffith. « Je suis convaincu que l’ajout de Breethe au portefeuille de produits d’Abiomed renforcera sa capacité à améliorer l’état de santé de ses patients et à servir une nouvelle population de patients. »
« Cette acquisition rentre dans le cadre d’une progression naturelle vers l’amélioration des soins, » a indiqué Matthew D. Bacchetta, maître de conférence à la faculté de chirurgie thoracique de l’université Vanderbilt. « La technologie compacte et tout-en-un de Breethe est conçue pour faciliter les déplacements des patients, ce qui pourrait améliorer leur état de santé et encourager une rééducation active chez les patients souffrant de troubles cardiopulmonaires. »
« Breethe s’intégrera à Abiomed et à ses installations de fabrication, de qualité, de vente, d’ingénierie et de recherche, et notamment au centre de soutien clinique d’Abiomed, de la plus haute qualité, » a déclaré Michael R. Minogue, président-directeur général d’Abiomed. « Cette acquisition s’aligne sur nos principes : montrer l’exemple en matière de technologie et d’innovation, placer les patients au premier plan et améliorer sans cesse leur état de santé. Des médecins ont demandé à Abiomed d’intégrer cette technologie dans notre portefeuille en raison de notre capacité à soutenir les patients, à enseigner les bonnes pratiques et à recueillir des données essentielles pour la recherche. La technologie de l’ECMO nous permettra de traiter les patients en état de choc cardiogénique qui bénéficient déjà d’une prise en charge avec Impella, d’ajouter une offre en pédiatrie et de traiter une nouvelle population de patients souffrant d’insuffisance respiratoire. »
Cette acquisition offre à Abiomed la possibilité d’innover et d’améliorer la technologie traditionnelle de l’ECMO, en se concentrant sur la capacité de déplacement des patients et leur rétablissement après une insuffisance respiratoire aiguë. Pour de nombreux patients en état de choc cardiogénique, Impella représente la technologie optimale, car elle assure la décharge du ventricule gauche et la perfusion des organes cibles, ce qui permet au cœur de se reposer et de récupérer. Abiomed reconnaît que les patients en état de choc cardiogénique peuvent également avoir besoin d’une oxygénation. L’ECMO perfuse les organes cibles mais ne permet pas de décharger le ventricule gauche, ce qui augmente la demande en oxygène du myocarde (muscle cardiaque) chez ces patients. Chez les patients en état de choc cardiogénique, l’ensemble Impella + ECMO (ECPella) va permettre de décharger le cœur et d’oxygéner le corps.
De nombreuses études appuient l’utilisation de l’ECPella pour améliorer l’état de santé des patients en état de choc cardiogénique ayant besoin d’être oxygénés. L’European Journal of Heart Failure, l’ASAIO et le Journal of the American College of Cardiology have published studies that examine a combined 4,126 patients and conclude use of ECPella was associated with increased survival rates, as compared to patients who were treated with ECMO only. (See figure 1.) In addition to higher survival, the study in the European Journal of Heart Failure ont publié des études portant sur un total de 4 126 patients et ont conclu que l’utilisation d’ECPella était associée à un meilleur taux de survie, par rapport aux patients pris en charge uniquement avec l’ECMO (voir figure 1). Outre le taux de survie plus élevé, l’étude de Pappalardo et al. publiée dans l’European Journal of Heart Failure a révélé des taux de rétablissement du cœur plus élevés avec ECPella qu’avec l’ECMO seule (62 % contre 36 % ; p=0,048).
Les conditions de l’accord d’acquisition n’ont pas été divulguées pour le moment.
À PROPOS DES POMPES CARDIAQUES IMPELLA
Les dispositifs Impella 2.5® et Impella CP® bénéficient d’une approbation avant commercialisation de la FDA américaine pour le traitement de certains patients atteints d’insuffisance cardiaque avancée qui subissent des interventions coronaires percutanées (ICP) électives et urgentes, telles que l’angioplastie par pose de stent ou de ballonnet, afin de rouvrir les artères coronaires obstruées. Les dispositifs Impella 2.5, Impella CP, Impella CP avec SmartAssist®, Impella 5.0®, Impella LD® et Impella 5.5™ avec SmartAssist® sont des pompes cardiaques approuvées par la FDA américaine, utilisées pour traiter les patients subissant des crises cardiaques ou atteints de cardiomyopathie en état de choc cardiogénique. Elles possèdent la capacité unique de permettre la récupération de la fonction cardiaque native, permettant ainsi aux patients de rentrer chez eux sans être greffés. Le dispositif Impella RP® est approuvé par la FDA américaine pour traiter l’insuffisance ventriculaire droite ou une décompensation suite à l’implantation d’un dispositif d’assistance ventriculaire gauche, un infarctus du myocarde, une transplantation cardiaque ou une opération à cœur ouvert. Impella est le dispositif d’assistance circulatoire mécanique le plus étudié de toute l’histoire de la FDA, avec des études de la FDA sur plus de 10 ans, des données cliniques réelles portant sur plus de 140 000 patients et plus de 650 publications soumises à un comité de lecture.
En Europe, les dispositifs Impella 2.5, Impella CP et Impella CP avec SmartAssist sont certifiés CE pour le traitement des patients ICP à risque élevé et des patients AMI en état de choc cardiogénique pendant un maximum de 5 jours. Les pompes Impella 5.0 et Impella LD sont certifiées CE pour le traitement des patients atteints d’un infarctus ou d’une cardiomyopathie en état de choc cardiogénique pendant un maximum de 10 jours. La pompe Impella 5.5™ avec SmartAssist® est certifiée CE pour le traitement des patients atteints d’un infarctus ou d’une cardiomyopathie en état de choc cardiogénique pendant un maximum de 30 jours. La pompe Impella RP® est certifiée CE pour le traitement de l’insuffisance ventriculaire droite ou d’une décompensation suite à l’implantation d’un dispositif d’assistance ventriculaire gauche, un infarctus du myocarde, une transplantation cardiaque, une opération à cœur ouvert ou une arythmie ventriculaire réfractaire.
Pour en savoir plus sur le portefeuille de pompes cardiaques Impella, y compris sur les indications approuvées et les informations importantes en matière de sécurité et de risque associées à l’utilisation de ces dispositifs, rendez-vous sur www.impella.com.
À PROPOS D’ABIOMED
Basé à Danvers, dans le Massachusetts, aux États-Unis, Abiomed, Inc., est un fournisseur de premier plan de dispositifs médicaux offrant une assistance circulatoire. Nos produits sont conçus pour permettre au cœur de se reposer en améliorant la circulation sanguine et/ou en effectuant le pompage du cœur. Pour plus d’informations, veuillez consulter www.abiomed.com.
Abiomed, Impella, Impella 2.5, Impella 5.0, Impella LD, Impella CP, Impella RP et Impella Connect sont des marques déposées d’Abiomed, Inc., et sont enregistrées aux États-Unis ainsi que dans certains autres pays. Impella BTR, Impella 5.5, Impella ECP, CVAD Study et SmartAssist sont des marques commerciales d’Abiomed, Inc., en attente de dépôt.
À PROPOS DE BREETHE
Breethe a fait une demande d’autorisation 510(k) pour son système OXY-1, mais ne l’a pas encore reçue. Les informations contenues dans le présent document sur les futurs produits de Breethe sont destinées uniquement aux fins d’information des investisseurs et ne doivent pas être utilisées pour offrir un traitement médical. Rien dans le présent document ne doit être interprété comme une allégation de sécurité ou d’efficacité en ce qui concerne les futurs produits ou indications.
DÉCLARATIONS PROSPECTIVES
Le présent communiqué contient des déclarations prospectives, notamment des déclarations concernant le développement de produits existants et de nouveaux produits d’Abiomed, l’évolution de l’entreprise en matière de croissance commerciale, les occasions futures et les approbations réglementaires prévues. Les résultats réels de la société peuvent être sensiblement différents de ceux escomptés dans ces déclarations prospectives en raison d’un certain nombre de facteurs, notamment les incertitudes liées à la portée, l’ampleur et la durée de la pandémie de COVID-19, au développement, aux tests et aux approbations réglementaires connexes, comme le potentiel de pertes futures, une fabrication complexe, des exigences de qualité élevées, la dépendance à l’égard de sources d’approvisionnement limitées, la concurrence, les changements technologiques, la réglementation gouvernementale, les litiges, les besoins en capitaux dans le futur et l’incertitude quant à l’obtention de financements supplémentaires, ainsi que d’autres risques et difficultés détaillés dans les documents déposés par la société auprès de la Securities and Exchange Commission, notamment le dernier rapport annuel déposé (formulaire 10-K) ainsi que les documents déposés ou présentés par la suite auprès de la SEC. Les lecteurs sont priés de ne pas se fier indûment aux déclarations prospectives, qui sont valables uniquement à la date du présent communiqué. La société n’est aucunement tenue de publier les résultats d’une quelconque révision de ces déclarations prospectives qui pourrait être faite afin de refléter des événements ou des circonstances survenant après la date de publication de ce communiqué ou pour refléter la survenue d’événements imprévus.
Le texte du communiqué issu d’une traduction ne doit d’aucune manière être considéré comme officiel. La seule version du communiqué qui fasse foi est celle du communiqué dans sa langue d’origine. La traduction devra toujours être confrontée au texte source, qui fera jurisprudence.
Consultez la version source sur businesswire.com : https://www.businesswire.com/news/home/20200429006017/fr/

