Ce communiqué de presse contient des éléments multimédias. Voir le communiqué complet ici : https://www.businesswire.com/news/home/20231031485256/fr/
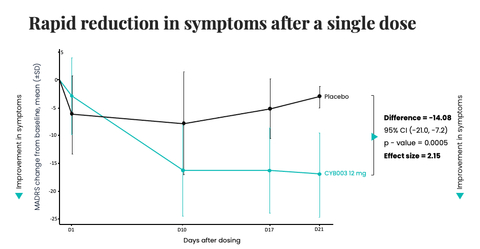
CYB003 (12mg dose) demonstrated a rapid and statistically significant reduction in symptoms of depression at three weeks after a single dose, meeting the primary efficacy endpoint (Graphic: Business Wire)
Cybin dévoile des résultats provisoires jamais vus pour la phase 2 de CYB003 dans le traitement du trouble dépressif majeur : le paramètre primaire d'efficacité est atteint et une amélioration significative et rapide des symptômes dépressifs est observable après une seule dose
Cybin Inc. (NYSE : CYBN) (NEO : CYBN) (« Cybin » ou « la Société »), société biopharmaceutique en phase clinique déterminée à révolutionner les soins de santé mentale au moyen de traitements psychédéliques innovants de nouvelle génération, a dévoilé aujourd'hui les résultats provisoires de la phase 2 de l'essai sur CYB003, son analogue deutéré de la psilocybine, lesquels démontrent une réduction rapide, vigoureuse et statistiquement significative des symptômes de dépression trois semaines après l'administration d'une dose unique de 12 mg comparé au placebo. Au paramètre primaire d'efficacité à 3 semaines, la réduction des symptômes du trouble dépressif majeur (TDM), définie comme variation par rapport au niveau de référence du score total MADRS, est supérieure de 14,08 points (p=0,0005, d de Cohen=2,15) chez les participants assignés au CYB003 comparé aux participants ayant reçu le placebo. Une valeur p indique une valeur statistiquement significative. En général, les valeurs <0,05 sont considérées comme statistiquement significatives et les valeurs <0,001 comme statistiquement très significatives.
« Les résultats provisoires très largement positifs pour la dose de 12 mg de CYB003 sont extrêmement encourageants pour les patients et les prestataires de soins. L'efficacité démontrée à cette posologie traduit une réduction sans précédent des symptômes dépressifs par rapport aux traitements actuellement disponibles » a affirmé Doug Drysdale, directeur général de Cybin. « Maintenant que nous disposons de ces résultats encourageants, nous avons hâte de rendre public le reste des données préliminaires d'ici la fin de l'année et les données de viabilité à 12 semaines au premier trimestre 2024. Notre plan se poursuit en préparation d'un essai de phase 3 international multisite de plus grande envergure début 2024 afin d'évaluer plus précisément l'innocuité et l'efficacité de CYB003 chez les personnes souffrant de TDM ».
L'essai clinique de phase 2 mesure l'efficacité à l'aide de l'échelle MADRS en prenant comme paramètre primaire la réduction des symptômes dépressifs (variation par rapport à l'échelle MADRS) 3 semaines après l'administration d'une dose unique. À ce jour, toutes les cohortes de dosage jusqu'à 16 mg ont été administrées ; le profil d'innocuité et de tolérabilité est favorable et aucun effet indésirable grave lié au traitement n'a été constaté. Les résultats provisoires de la cohorte de 12 mg font apparaître une réduction statistiquement et cliniquement significative des symptômes de dépression au bout de 3 semaines de traitement avec une seule dose.
L'échelle MADRS, qui est appréciée par un clinicien et comporte 10 items, est conçue pour mesurer la sévérité globale des symptômes dépressifs chez les sujets souffrant de TDM. Elle est très fréquemment employée dans les essais cliniques et acceptée par les autorités réglementaires du monde entier pour quantifier les symptômes de la dépression. L'échelle MADRS comprend des items couvrant la tristesse de l'humeur, la diminution du sommeil et la baisse d'appétit, les difficultés de concentration, l'anhédonie ou encore les pensées négatives et suicidaires. Ces items sont notés de 0 à 6 et le score total varie de 0 à 60. Les fourchettes-types de sévérité sont les suivantes : 0-6 normale ; 7-19 légère ; 20-34 modérée ; >34 dépression sévère. Dans l'étude sur CYB003, les scores moyens de référence sur l'échelle MADRS étaient de 32,6 et 33,3 dans le groupe actif et le groupe placebo, respectivement.
Résumé des résultats provisoires d'efficacité de CYB003 12mg à trois semaines :
-
Amélioration rapide et statistiquement significative des symptômes de dépression observée après l'administration d'une dose unique de CYB003 :
- Amélioration des symptômes de dépression évidente le jour suivant l'administration, atteignant un pic 10 jours après l'administration, et maintenue par la suite.
- Réduction vigoureuse et statistiquement significative des symptômes de dépression par rapport au placebo à 3 semaines, avec une différence de -14,08 par rapport au niveau de référence sur l'échelle MADRS comparé au placebo (p=0,0005).
-
Réponse vigoureuse (réduction ≥50 % sur l'échelle MADRS) et rémission (scores MADRS ≤10) trois semaines après l'administration d'une dose unique :
- Taux de réponse de 53,3 % pour CYB003 (12 mg) contre 0 % pour le placebo
- Taux de rémission de 20,0 % pour CYB003 (12 mg) contre 0 % pour le placebo
Innocuité et tolérabilité :
- CYB003 a été bien toléré et aucun effet indésirable grave lié au médicament n'a été constaté
- Tous les effets indésirables avaient une intensité légère ou modérée et se sont estompés spontanément sans intervention
« Ces résultats provisoires positifs concernant l'innocuité et l'efficacité confortent une progression vers des études pivots. Nous entendons solliciter une réunion de fin de phase 2 avec la FDA début 2024 pour nous calquer sur la conception de l'essai de phase 3, et nous allons débuter l'administration avec une formulation en gélules de CYB003 dans la cohorte de bioéquivalence et poursuivre la fabrication de matériaux assurés BPF flexibles du point de vue du dosage, adaptés aux patients et évolutifs commercialement. C'est une période passionnante - pour Cybin, mais également pour le secteur des psychédéliques dans son ensemble - car nous disposons désormais de résultats provisoires montrant une amélioration significative des symptômes dépressifs après une seule dose, ce qui nous rapproche plus que jamais de notre mission visant à améliorer le choix des traitements sur le spectre des troubles de la santé mentale » a conclu D. Drysdale.
Amir Inamdar, médecin en chef chez Cybin, a déclaré : « Les problèmes de santé mentale touchent près d'un milliard de personnes à travers le monde. Le TDM est une comorbidité fréquente dans les troubles médicaux et psychiatriques, notamment les troubles anxieux et le syndrome de stress post-traumatique. Ces résultats provisoires, ainsi que les données qui émergent d'un certain nombre d'études universitaires, laissent penser que CYB003 pourrait avoir une efficacité thérapeutique pour une batterie de troubles mentaux ».
Les grandes échéances à venir :
Les données préliminaires complètes sur l'innocuité et l'efficacité de l'étude TDM CYB003 sont attendues d'ici la fin du quatrième trimestre 2023 et les données de viabilité à 12 semaines au premier trimestre 2024. Cybin prévoit de présenter ces données préliminaires à la FDA et de solliciter une réunion de fin de phase 2 au premier trimestre 2024. Le recrutement pour l'étude de phase 3 de CYB003 devrait commencer d'ici la fin du premier trimestre 2024.
La Société prévoit également de rendre publiques les données préliminaires de la phase 1 pour CYB004 et SPL028, ses nouveaux composés deutérés de N,N-diméthyltryptamine (« DMT »), avant la fin de 2023, pour appuyer le lancement d'une étude de phase 2 chez les participants souffrant de troubles anxieux généralisés au premier trimestre 2024.
Détails de la conférence téléphonique et du webcast :
Date : | Mercredi 1er novembre 2023 | ||
|
| ||
Heure : | 11h00 (HE) | ||
|
| ||
Numéro à composer : | 800-245-3047 (gratuit aux USA) ou 203-518-9765 (international) | ||
|
| ||
ID de la conférence : | CYBN1101 | ||
|
| ||
Webcast : | S'inscrire au webcastici |
Le webcast archivé sera également disponible sur le site web des relations avec les investisseurs de Cybin, à la page Événements & présentations.
À propos de l'essai CYB003 de phase 1/2
L'essai de phase 1/2 est une étude randomisée en double aveugle contrôlée par placebo qui évalue CYB003 chez des participants souffrant de TDM modéré à sévère et chez des volontaires en bonne santé. Les participants atteints de TDM reçoivent deux doses (placebo/actif et actif/actif) à trois semaines d'intervalle et la réponse/rémission est évaluée trois semaines après chaque dose. Les participants actuellement sous antidépresseurs sont autorisés à poursuivre leur traitement.
L'étude évalue l'innocuité, la tolérabilité, la pharmacocinétique et la pharmacodynamique ainsi que l'effet psychédélique de doses orales croissantes de CYB003. Chez les participants souffrant de TDM, l'essai évalue l'apparition rapide de l'effet antidépresseur le jour de l'administration à l'aide de l'échelle MADRS afin d'apprécier le bénéfice progressif d'une seconde dose de CYB003 administrée en troisième semaine. Une période d'évaluation facultative permettra de déterminer la viabilité du traitement sur une durée de 12 semaines. L'étude est répertoriée sur ClinicalTrials.gov sous l'identifiant : NCT05385783.
À propos de Cybin
Cybin est une société biopharmaceutique en phase clinique dont la mission est de créer des thérapies à base de psychédéliques sûres et efficaces pour combler le besoin insatisfait de traitements nouveaux et innovants pour les personnes souffrant de troubles mentaux.
L'objectif de Cybin de révolutionner les soins de santé mentale est soutenu par un réseau de partenaires de classe mondiale et de scientifiques de renommée internationale visant à faire progresser les plateformes de découverte de médicaments exclusifs, les systèmes d'administration de médicaments innovants, les nouvelles approches de formulation et les régimes de traitement. La Société développe actuellement CYB003, un analogue deutéré de la psilocybine pour le traitement du trouble dépressif majeur, et CYB004, une molécule deutérée pour le traitement des troubles anxieux généralisés, et dispose d'une filière de recherche de composés psychédéliques expérimentaux.
Sise au Canada et fondée en 2019, Cybin opère au Canada, aux États-Unis, au Royaume-Uni, aux Pays-Bas et en Irlande. Pour suivre l'actualité de la Société et en savoir plus sur Cybin, veuillez consulter www.cybin.com ou suivez-la sur X, LinkedIn, YouTube et Instagram.
Mises en garde et déclarations prospectives
Certaines déclarations figurant dans le présent communiqué de presse relatif à la Société ont un caractère prévisionnel. Les déclarations prospectives ne sont pas basées sur des faits historiques, mais sur des attentes actuelles et des projections d'évènements futurs et sont par conséquent soumises aux risques et incertitudes qui pourraient faire que les résultats réels diffèrent considérablement des résultats futurs exprimés ou impliqués dans les déclarations prospectives. Ces déclarations peuvent être identifiées de façon générale par l'emploi de verbes tels que « pouvoir », « devoir », « avoir l'intention de », « estimer », « prévoir », « anticiper », « s'attendre à », « penser que » ou « continuer » ou les formes négatives ou des variations similaires de ces verbes. Les déclarations prospectives du présent communiqué de presse comprennent des déclarations relatives aux projets de Cybin de soumettre un rapport, fin 2023 sur les données d’innocuité et d’efficacité de la phase 2 de son programme d'analogue deutéré de la psilocybine, CYB003, la publication des données de viabilité de CYB003 à 12 semaines au T1 2024, la progression vers la phase 3 du développement de CYB003 début 2024, le recrutement pour une étude de phase 3 sur CYB003 et le début de l'étude de phase 3 à la fin du T1 2024, le projet de la Société de solliciter une réunion de fin de phase 2 avec la FDA début 2024, les données de base de phase 1 pour CYB004 et SPL028, les nouveaux composés DMT deutérés exclusifs de la Société avant fin 2023, le début d'une étude de phase 2 sur les nouveaux composés deutérés DMT de la Société chez des patients souffrant de troubles anxieux généralisés au T1 2024 et les plateformes de découverte de médicaments de la Société, ses systèmes d'administration de médicaments innovants, ses nouvelles approches de formulation et ses régimes de traitement pour les troubles de la santé mentale.
Ces déclarations prospectives sont fondées sur des hypothèses raisonnables et des estimations relatives à la gestion de la Société au moment de l’établissement des déclarations. Les résultats futurs peuvent en différer substantiellement car les déclarations prospectives impliquent des risques connus et inconnus, des incertitudes et d'autres facteurs qui peuvent faire en sorte que les résultats, les performances ou les réalisations de Cybin diffèrent substantiellement des résultats, des performances ou des réalisations exprimés ou sous-entendus dans ces déclarations prospectifs. De tels facteurs, entre autres, incluent : les implications de la propagation de la COVID-19 sur les activités de la Société, les fluctuations des conditions macroéconomiques générales, les fluctuations des bourses, les attentes concernant la taille du marché des substances psychédéliques, la capacité de la Société à atteindre ses objectifs commerciaux, les plans de croissance, les incertitudes politiques, sociales et environnementales, les relations avec les employés, la présence de lois et de réglementations pouvant imposer des restrictions sur les marchés où opère Cybin et les facteurs de risque énoncés dans le rapport de gestion de la Société pour le trimestre clos au 30 juin 2023 et dans la notice annuelle de la Société pour l'exercice clos au 31 mars 2023, qui sont disponibles sous le profil de la Société sur SEDAR+ à l'adresse www.sedarplus.ca et auprès de la Securities and Exchange Commission des États-Unis sur EDGAR à l'adresse www.sec.gov. Bien que les déclarations prospectives figurant dans le présent communiqué de presse soient fondées sur ce que la direction de la Dociété estime - ou estimait à ce moment-là - être des hypothèses raisonnables, la Société ne peut garantir aux actionnaires que les résultats réels seront conformes à ces déclarations prospectives, car d'autres facteurs peuvent faire en sorte que les résultats ne soient pas conformes aux prévisions, aux estimations ou aux intentions. Le lecteur ne doit pas se fier indûment aux déclarations et informations prospectives contenues dans le présent communiqué de presse. La Société n'a pas l'obligation de mettre à jour les déclarations prospectives concernant les opinions, les projections ou d'autres facteurs, si ceux-ci venaient à changer, sauf si la loi l'exige.
Cybin ne fait aucune allégation médicale, de traitement ou de prestations de santé sur ses produits. Ni la Food and Drug Administration (FDA) des États-Unis, ni Santé Canada ni aucune autre autorité réglementaire n'a évalué les affirmations concernant la psilocybine, les tryptamines psychédéliques, les dérivés de tryptamine ou d'autres composés psychédéliques. L'efficacité de ces produits n'a pas été confirmée par des recherches approuvées. Il n'y a aucune garantie que l'utilisation de la psilocybine, des tryptamines psychédéliques, des dérivés de tryptamine ou d'autres composés psychédéliques puisse diagnostiquer, traiter, guérir ou prévenir toute maladie ou condition. Des recherches scientifiques rigoureuses et des essais cliniques sont nécessaires. Cybin n'a pas mené d'essais cliniques pour l'utilisation de ses produits candidats. Toute référence à la qualité, la cohérence, l'efficacité et l’innocuité des produits potentiels n'implique pas que Cybin ait vérifié de tels éléments dans le cadre d'essais cliniques, ni que Cybin réalisera de tels essais. Si Cybin ne parvient pas à obtenir les approbations ou les recherches nécessaires pour commercialiser ses produits, cela pourrait avoir un effet néfaste et non négligeable sur les performances et les opérations de Cybin.
Ni Neo Exchange Inc. ni la bourse NYSE American LLC n'a approuvé ou désapprouvé le contenu de ce communiqué de presse ; celles-ci ne pourraient être tenues responsables de l’exactitude et de la pertinence de ce communiqué de presse.
Notes de bas de page
- FETZIMA® est une marque déposée d'Allergan Sales, LLC, société du groupe AbbVie. VIIBRYD® est une marque déposée d'Allergan Sales, LLC, société du groupe AbbVie. TRINTELLIX® (anciennement BRINTELLIX) est une marque de H. Lundbeck A/S déposée auprès du U.S. Patent and Trademark Office et utilisée sous licence par Takeda Pharmaceuticals America, Inc. VRAYLAR® est une marque d'Allergan Pharmaceuticals International Limited, société du groupe AbbVie. AUVELITY® est une marque déposée d'Axsome Therapeutics, Inc. SPRAVATO® est une marque déposée de Johnson & Johnson Corporation. Les marques de tiers utilisées dans le présent document appartiennent à leurs propriétaires respectifs.
Le texte du communiqué issu d’une traduction ne doit d’aucune manière être considéré comme officiel. La seule version du communiqué qui fasse foi est celle du communiqué dans sa langue d’origine. La traduction devra toujours être confrontée au texte source, qui fera jurisprudence.
Consultez la version source sur businesswire.com : https://www.businesswire.com/news/home/20231031485256/fr/


